Difference between revisions of "GFP"
(ref +ref +ref +ref +ref +ref +ref +ref +ref +ref +ref +ref +ref) |
|||
| (2 intermediate revisions by one other user not shown) | |||
| Line 1: | Line 1: | ||
Groen fluorescent proteïne of GFP (meestal wordt de engelse benaming gebruitkt: Green Fluorescent Protein) is een fluorescent eiwit uit de kristalkwal ([http://www.marinespecies.org/aphia.php?p=taxdetails&id=283998 ''Aequorea victoria'']). Hoewel er vele andere organismen zijn die gelijkaardige proteïnen bevatten verwijst GFP bijna altijd naar het eiwit uit de kristalkwal<ref name="one">Pieribone V, Gruber D. 2006. Aglow in the Dark: The Revolutionary Science of Biofluorescence. Cambridge: Belknap Press.</ref>. Sinds de ontdekking in 1962 is het gebruik van GFP's sterk toegenomen, en speelt het een belangrijke rol binnen de moleculaire biologie. Het GFP eiwit wordt voornamelijk gebruikt als receptorgen, oftewel als label voor expressie van onderzochte genen. Een gen van een te onderzoeken organisme wordt zo gemanipuleerd dat in regios waar het gen tot expressie komt, GFP mee geproduceerd word. Dit laat wetenschappers toe na te gaan in welke weefsels/regio’s een gen tot expressie komt. | Groen fluorescent proteïne of GFP (meestal wordt de engelse benaming gebruitkt: Green Fluorescent Protein) is een fluorescent eiwit uit de kristalkwal ([http://www.marinespecies.org/aphia.php?p=taxdetails&id=283998 ''Aequorea victoria'']). Hoewel er vele andere organismen zijn die gelijkaardige proteïnen bevatten verwijst GFP bijna altijd naar het eiwit uit de kristalkwal<ref name="one">Pieribone V, Gruber D. 2006. Aglow in the Dark: The Revolutionary Science of Biofluorescence. Cambridge: Belknap Press.</ref>. Sinds de ontdekking in 1962 is het gebruik van GFP's sterk toegenomen, en speelt het een belangrijke rol binnen de moleculaire biologie. Het GFP eiwit wordt voornamelijk gebruikt als receptorgen, oftewel als label voor expressie van onderzochte genen. Een gen van een te onderzoeken organisme wordt zo gemanipuleerd dat in regios waar het gen tot expressie komt, GFP mee geproduceerd word. Dit laat wetenschappers toe na te gaan in welke weefsels/regio’s een gen tot expressie komt. | ||
| + | |||
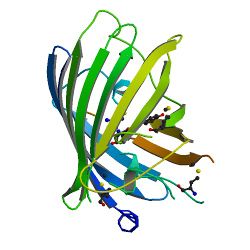
| + | [[Image: GFP.jpg |thumb|right|250px|Figuur 1<ref name="struct">http://www.rcsb.org/pdb/explore/explore.do?pdbId=1EMA</ref>: 3D structuur van GFP]] | ||
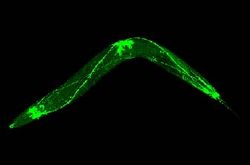
| + | [[Image: GFPnerves.jpg|thumb|right|250px|Figuur 2<ref name="nerve">http://www.wormclassroom.org/image/nerve-system-labeled-gfp</ref>: GFP komt tot expressie samen met eiwitten uit de zenuwbanen van een rondworm (''Caenorhabditis elegans''). Hierdoor wordt het zenuwstelsel duidelijk zichtbaar.]] | ||
===Werking=== | ===Werking=== | ||
| Line 12: | Line 15: | ||
GFP wordt veelvuldig gebruikt om na te gaan in welke weefsels of regio’s een bepaald gen tot expressie komt. Hiervoor wordt een deel van het gen uit de kristalkwal dat codeert voor de productie van GFP ingevoegd (splicing) in het DNA van het te onderzoeken organisme<ref name="work">Rafael Yuste (2005) Fluorescence microscopy today. Nature Methods 2, 902 - 904 doi:10.1038/nmeth1205-902</ref>. Voor onderzoek van een gegeven eitwit wordt het GFP gen gespliced in dezelfde regulatorische sequentie als die van het te onderzoeken eiwit, met als resultaat dat overal waar het gezochte eiwit geproduceerd wordt, GFP ook geproduceerd word. De fluorecente eigenschappen van GFP maken het zo heel eenvoudig om onder een microscoop na te gaan waar het eiwit geproduceerd word, omdat deze zones groen gaan oplichten. Vroeger werd gebruik gemaakt van radioactieve merkers, maar het gebruik van GFP bleek veel veiliger en efficiënter waardoor het vandaag niet meer weg te denken is uit in biotechnologisch labo. | GFP wordt veelvuldig gebruikt om na te gaan in welke weefsels of regio’s een bepaald gen tot expressie komt. Hiervoor wordt een deel van het gen uit de kristalkwal dat codeert voor de productie van GFP ingevoegd (splicing) in het DNA van het te onderzoeken organisme<ref name="work">Rafael Yuste (2005) Fluorescence microscopy today. Nature Methods 2, 902 - 904 doi:10.1038/nmeth1205-902</ref>. Voor onderzoek van een gegeven eitwit wordt het GFP gen gespliced in dezelfde regulatorische sequentie als die van het te onderzoeken eiwit, met als resultaat dat overal waar het gezochte eiwit geproduceerd wordt, GFP ook geproduceerd word. De fluorecente eigenschappen van GFP maken het zo heel eenvoudig om onder een microscoop na te gaan waar het eiwit geproduceerd word, omdat deze zones groen gaan oplichten. Vroeger werd gebruik gemaakt van radioactieve merkers, maar het gebruik van GFP bleek veel veiliger en efficiënter waardoor het vandaag niet meer weg te denken is uit in biotechnologisch labo. | ||
| − | + | ||
| − | |||
===Oorsprong & Ontwikkeling=== | ===Oorsprong & Ontwikkeling=== | ||
| Line 19: | Line 21: | ||
GFP werd in 1961 ontdekt door Osamu Shimomura als bij-product van de geëxtraheerde luminescente stof aequorin uit [http://www.marinespecies.org/aphia.php?p=taxdetails&id=283998 ''Aequorea victoria''] <ref name="three">Shimomura O. 2005. The discovery of aequorin and green fluorescent protein. Journal of Microscopy 217(1): 1-15.</ref>. De toepassing van de stof werd pas duidelijk in de loop der jaren. In 1994 lukte het het laboratorium van Martin Chalfie GFP in levende cellen tot expressie te brengen<ref name="seven">Chalfie, M, Tu Y, Euskirchen G, Ward WW, Prasher DC. 1994. Green fluorescent protein as a marker for gene expression. Science 263: 802–805.</ref>. De structuur van het GFP chromofoor werd opgehelderd <ref name="eight">Shimomura O. 1979 Structure of the chromophore of Aequorea green fluorescrent protein. FEBS Lett. 104: 220–222.</ref>, en de structuur van het eiwit GFP ontdekt<ref name="eleven">Yang F, Moss LG, Phillips GNJ .1996.The molecular structure of green fluorescent protein. Nature Biotechnol. 14: 1246–1251.</ref>. In 1995 . werd de bruikbaarheid van GFP sterk verbeterd door Roger Tsien door o.a. een versterkte en stabielere fluorescentie<ref name="twelve">Heim R, Cubitt A, Tsien R .1995. Improved green fluorescence. Nature 373 : 663–4.</ref>. | GFP werd in 1961 ontdekt door Osamu Shimomura als bij-product van de geëxtraheerde luminescente stof aequorin uit [http://www.marinespecies.org/aphia.php?p=taxdetails&id=283998 ''Aequorea victoria''] <ref name="three">Shimomura O. 2005. The discovery of aequorin and green fluorescent protein. Journal of Microscopy 217(1): 1-15.</ref>. De toepassing van de stof werd pas duidelijk in de loop der jaren. In 1994 lukte het het laboratorium van Martin Chalfie GFP in levende cellen tot expressie te brengen<ref name="seven">Chalfie, M, Tu Y, Euskirchen G, Ward WW, Prasher DC. 1994. Green fluorescent protein as a marker for gene expression. Science 263: 802–805.</ref>. De structuur van het GFP chromofoor werd opgehelderd <ref name="eight">Shimomura O. 1979 Structure of the chromophore of Aequorea green fluorescrent protein. FEBS Lett. 104: 220–222.</ref>, en de structuur van het eiwit GFP ontdekt<ref name="eleven">Yang F, Moss LG, Phillips GNJ .1996.The molecular structure of green fluorescent protein. Nature Biotechnol. 14: 1246–1251.</ref>. In 1995 . werd de bruikbaarheid van GFP sterk verbeterd door Roger Tsien door o.a. een versterkte en stabielere fluorescentie<ref name="twelve">Heim R, Cubitt A, Tsien R .1995. Improved green fluorescence. Nature 373 : 663–4.</ref>. | ||
| − | Martin Chalfie, Osamu Shimomura en Roger Y. Tsien kregen in 2008 de Nobelpreis voor de Scheikunde voor de ontdekking en ontwikkeling van GFP <ref name="thirteen">http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2008 | + | Martin Chalfie, Osamu Shimomura en Roger Y. Tsien kregen in 2008 de Nobelpreis voor de Scheikunde voor de ontdekking en ontwikkeling van GFP <ref name="thirteen">http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2008.</ref>. |
| Line 32: | Line 34: | ||
[[Lijst van mariene biotechnologie toepassingen]] | [[Lijst van mariene biotechnologie toepassingen]] | ||
| + | [[Category:Marine biotechnologie toepassingen]] | ||
Latest revision as of 10:21, 7 November 2013
Groen fluorescent proteïne of GFP (meestal wordt de engelse benaming gebruitkt: Green Fluorescent Protein) is een fluorescent eiwit uit de kristalkwal (Aequorea victoria). Hoewel er vele andere organismen zijn die gelijkaardige proteïnen bevatten verwijst GFP bijna altijd naar het eiwit uit de kristalkwal[1]. Sinds de ontdekking in 1962 is het gebruik van GFP's sterk toegenomen, en speelt het een belangrijke rol binnen de moleculaire biologie. Het GFP eiwit wordt voornamelijk gebruikt als receptorgen, oftewel als label voor expressie van onderzochte genen. Een gen van een te onderzoeken organisme wordt zo gemanipuleerd dat in regios waar het gen tot expressie komt, GFP mee geproduceerd word. Dit laat wetenschappers toe na te gaan in welke weefsels/regio’s een gen tot expressie komt.
Contents
Werking
Luminescentie
Luminescentie komt voor bij een verscheidenheid aan mariene ongewervelden. Veel neteldieren (cnidaria) zenden licht uit wanneer zij mechanisch verstoord worden. Het licht van luminescente neteldieren is voornamelijk groen[4]. Dit groen licht is afkomstig van een klasse van eiwitten genaamd green-fluorescent proteins (GFP’s). In A. victoria gebeurt GFP fluorescentie wanneer het eiwit aequorin interageert met Ca2+ ionen, en daarbij een blauwe gloed veroorzaakt. Een deel van deze luminescente energie wordt overgebracht naar het eiwit GFP, welke de uitgezonden kleur naar groen verschuift[5].
Gebruik in de biotechnologie
GFP wordt veelvuldig gebruikt om na te gaan in welke weefsels of regio’s een bepaald gen tot expressie komt. Hiervoor wordt een deel van het gen uit de kristalkwal dat codeert voor de productie van GFP ingevoegd (splicing) in het DNA van het te onderzoeken organisme[6]. Voor onderzoek van een gegeven eitwit wordt het GFP gen gespliced in dezelfde regulatorische sequentie als die van het te onderzoeken eiwit, met als resultaat dat overal waar het gezochte eiwit geproduceerd wordt, GFP ook geproduceerd word. De fluorecente eigenschappen van GFP maken het zo heel eenvoudig om onder een microscoop na te gaan waar het eiwit geproduceerd word, omdat deze zones groen gaan oplichten. Vroeger werd gebruik gemaakt van radioactieve merkers, maar het gebruik van GFP bleek veel veiliger en efficiënter waardoor het vandaag niet meer weg te denken is uit in biotechnologisch labo.
Oorsprong & Ontwikkeling
GFP werd in 1961 ontdekt door Osamu Shimomura als bij-product van de geëxtraheerde luminescente stof aequorin uit Aequorea victoria [7]. De toepassing van de stof werd pas duidelijk in de loop der jaren. In 1994 lukte het het laboratorium van Martin Chalfie GFP in levende cellen tot expressie te brengen[8]. De structuur van het GFP chromofoor werd opgehelderd [9], en de structuur van het eiwit GFP ontdekt[10]. In 1995 . werd de bruikbaarheid van GFP sterk verbeterd door Roger Tsien door o.a. een versterkte en stabielere fluorescentie[11].
Martin Chalfie, Osamu Shimomura en Roger Y. Tsien kregen in 2008 de Nobelpreis voor de Scheikunde voor de ontdekking en ontwikkeling van GFP [12].
Referenties
- ↑ Pieribone V, Gruber D. 2006. Aglow in the Dark: The Revolutionary Science of Biofluorescence. Cambridge: Belknap Press.
- ↑ http://www.rcsb.org/pdb/explore/explore.do?pdbId=1EMA
- ↑ http://www.wormclassroom.org/image/nerve-system-labeled-gfp
- ↑ Prasher D, Eckenrode V, Ward W, Prendergast F, Cormier M. 1992. Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111 (2): 229–33.
- ↑ Morin JG,Hastings, JW. 1971. Energy transfer in a bioluminescent system. J. Cell. Physiol. 77: 313–318.
- ↑ Rafael Yuste (2005) Fluorescence microscopy today. Nature Methods 2, 902 - 904 doi:10.1038/nmeth1205-902
- ↑ Shimomura O. 2005. The discovery of aequorin and green fluorescent protein. Journal of Microscopy 217(1): 1-15.
- ↑ Chalfie, M, Tu Y, Euskirchen G, Ward WW, Prasher DC. 1994. Green fluorescent protein as a marker for gene expression. Science 263: 802–805.
- ↑ Shimomura O. 1979 Structure of the chromophore of Aequorea green fluorescrent protein. FEBS Lett. 104: 220–222.
- ↑ Yang F, Moss LG, Phillips GNJ .1996.The molecular structure of green fluorescent protein. Nature Biotechnol. 14: 1246–1251.
- ↑ Heim R, Cubitt A, Tsien R .1995. Improved green fluorescence. Nature 373 : 663–4.
- ↑ http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2008.
- ↑ http://www.advancedaquarist.com/2005/12/aafeature2
